در این مقاله میخواهیم تئوری اسپکتروفتومتری و جذب نور فرابنفش-مرئی را برای شما شرح دهیم. آزمایشگاه شيمي تجزيه از پدیده طیف الکترومغناطیسی برای تعداد بیشماری از آنالیزها استفاده میکند. شیمیدانان و تکنسینها در آزمایشگاه شيمي تجزيه اغلب از برهمکنش ویژه مولکولها با تابش الکترومغناطیسی با کمک ابزارهای تجزيه اي مانند طیفسنجهای فرابنفش/مرئی (UV-Vis)، فلورومترها و طیفسنجهای تبدیل فوریه مادون قرمز (FT-IR) استفاده میکنند. گاهی اوقات، نوع دیگری از آنالیز به نام آنالیز رنگ سنجی انجام می شود که در آن از چشم برای تشخیص تفاوت رنگ ها استفاده می شود.
حتی اگر هنوز از آنالیز رنگ سنجی استفاده می شود، ما بر آناليز اسپکتروفتومتری تمرکز خواهیم کرد. همانطور که خواهیم دید، هر دو تجزیه کمی و کیفی به طور معمول توسط شیمیدان و تکنسین در آزمایشگاه شيمي تجزيه با استفاده از تابش الکترومغناطیسی انجام می شود.
اغلب، آنالیز UV-Vis و فلورومتری با ترکیباتی در محلول انجام میشود که آنالیت مورد نظر یا مستقیماً با توجه به ویژگیهای طیفسنجی آن اندازهگیری میشود، یا ممکن است با یک کروموفور یا فلوروفور ترکیب شود تا اندازهگیری آن امکانپذیر باشد. اجازه دهید با نگاهی به اصول اولیه تابش الکترومغناطیسی، به ویژه طیف الکترومغناطیسی، و نحوه استفاده از این پدیده در اطراف خود برای اندازه گیری ترکیبات در آزمایشگاه شيمي تجزيه شروع کنیم. طیف مرئی، چیزی که اکثر ما معمولاً با آن آشنا هستیم، بخش کوچکی از کل طیف تابش الکترومغناطیسی را تشکیل می دهد.
تقریباً اغلب تشعشعاتی که ما را احاطه کرده اند قابل مشاهده نیستند، اما توسط ابزارهای اسپکتروفتومتری تشخیص داده می شوند. کل طیف الکترومغناطیسی شامل طول موج های بسیار کوتاه (شامل پرتوهای گاما و ایکس) تا طول موج های بسیار بلند (شامل امواج مایکروویو و امواج رادیویی) مي باشد. اجازه دهید به شکل شماره 1-1 نگاه کنیم که نواحی مختلف طیف الکترومغناطیسی را نشان می دهد.

اسپکتروفتومتری فرابنفش-مرئي (UV-Vis)
جهان ما خوشبختانه مانند یک تلویزیون قدیمی سیاه و سفید نیست، بلکه پر از سایه های مختلف رنگی است. دلیل اینکه ما چیزی را قرمز می بینیم به دلیل جذب بخش طول موج خاصی از طیف مرئی است که توسط جسم جذب می شود در حالی که رنگ های دیگر رنگی را تشکیل می دهند که ما در این مثال قرمز می بینیم. میتوانیم عملکرد چشم انسان را به عنوان یک طیفسنج در نظر بگیریم که نور مشاهدهشده از جسمی را که قرمز به نظر میرسد، تجزیه و تحلیل میکند.
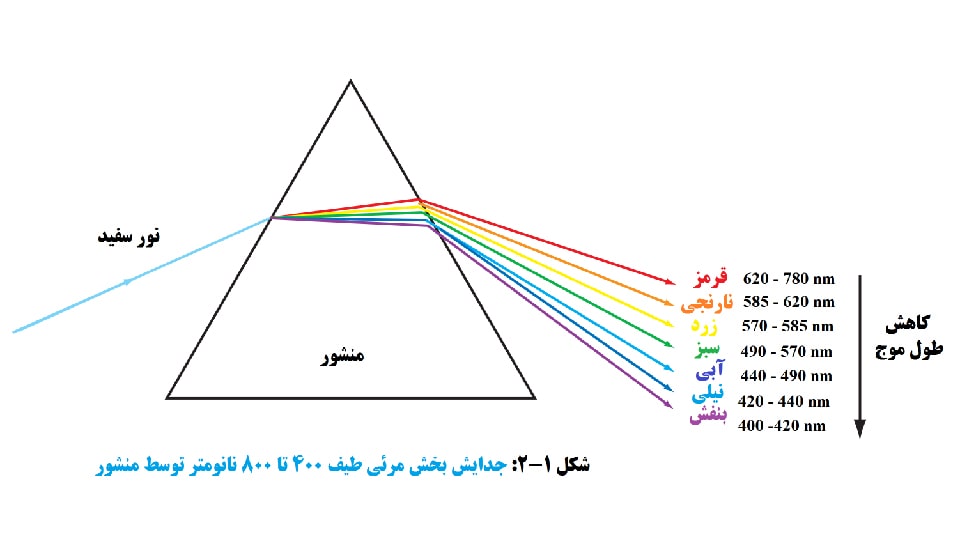
نور خورشید (یا نور سفید) که به رنگ یکنواخت یا همگن می بینیم از طیف وسیعی از طول موج های تابش در بخش های فرابنفش، مرئی و مادون قرمز طیف تشکیل شده است. بخش مرئی طیف، تقریباً از 400 تا 800 نانومتر، میتواند به رنگهای جزيي که با عبور نور خورشید از یک منشور میبینیم، جدا شود. پمنشور عمل می کند تا نور را در درجات مختلف با توجه به طول موج خم کند. طول موج هایی که به عنوان رنگ های خاص در قسمت مرئی طیف توسط يك منشور دیده می شوند در شکل 1-2 فهرست شده اند.
نظریه موجي و ذره اي نور
تابش الکترومغناطیسی نور مرئی به صورت دوگانه به عنوان یک پدیده موجی (نظریه موج) توصیف می شود که با طول موج یا فرکانس مشخص می شود که برای توصیف اثرات نوری مانند پراش و شکست مورد نیاز است. نور همچنین توسط نظریه ذره اي توصیف می شود که برای توصیف جذب و انتشار انرژی تابشی لازم است.
“طول موج” فاصله بین قله های مجاور (یا فرورفتگی ها) است و ممکن است بر حسب متر، سانتی متر یا نانومتر تعیین شود. «فرکانس» تعداد سیکلهای موجی است که از یک نقطه ثابت در واحد زمان عبور میکنند و معمولاً بر حسب سیکل در ثانیه یا هرتز داده میشود. قرمز طولانی ترین طول موج قابل مشاهده و بنفش کوتاه ترین طول موج است. در کل طیف نشان داده شده در شکل 1-2 که شامل ناحیه مرئی است، انرژی حمل شده توسط یک فوتون با طول موج معین متناسب با فرکانس آن است. معادلات زیر این روابط را توصیف می کنند:

انتقال های جذب نور
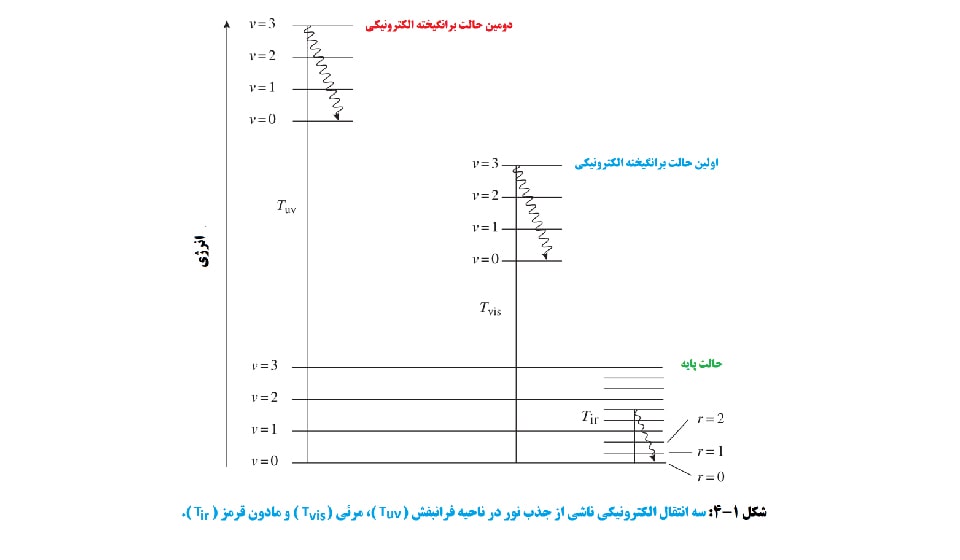
هنگامی که یک ترکیب نور را جذب می کند، انتقال یک الکترون لایه ظرفیت بیرونی از حالت انرژی پایه خود به سطح انرژی بالاتری به نام حالت برانگیخته ایجاد می کند. این انتقال ها در شکل 1-4 نشان داده شده است. بالاترین انتقال انرژی شامل جذب نور فرابنفش (190 تا 400 نانومتر) به دومین حالت برانگیخته الکترونیکی است. انتقال بعدی، جذب نور مرئی (400 تا 800 نانومتر) به اولین حالت برانگیخته الکترونیکی است. در نهایت، جذب در ناحیه مادون قرمز (1000 تا 1500 نانومتر) وجود دارد که کمترین مقدار انتقال انرژی است. هر حالت برانگیخته الکترونیکی نیز دارای تعدادی سطح ارتعاشی است (ν= 0, 1, 2, …). هنگامی که الکترون آسايش پيدا مي كند، تا پایین ترین سطح ارتعاشی پایین می آید.
چرخ رنگ نشان داده شده در شکل 1-5 برای پیش بینی اینکه وقتی یک ماده انرژی را در طول موج های مختلف جذب می کند چه رنگی دیده می شود استفاده می شود. اگر چیزی انرژی را در یک محدوده طول موج جذب کند، رنگ مکمل که در چرخه رنگ به طور مستقیم مقابل آن است، مشاهده می شود. به عنوان مثال، فرض کنید جسمي از 580 تا 600 نانومتر نور جذب می کند، رنگ مکمل مشاهده شده برای ماده جذب کننده آبی خواهد بود.

طیف جذبی فرابنفش-مرئي (UV-Vis)
همانطور که قبلا در چرخه رنگ دیدیم، رنگ یک ترکیب، معمولاً در آب یا یک حلال آلی به طول موج نور جذب شده بستگی دارد. اجازه دهید نگاهی عمیق تر به نحوه جذب اتم ها و مولکول ها برای تولید رنگ های مختلف بیندازیم. از این نظر، وقتی به نور اشاره می کنیم، در مورد نور سفیدی صحبت می کنیم که دارای محدوده طول موج 200 تا 800 نانومتر است. هنگامی که اتمها یا مولکولهای نمونه ما که در حال آزمایش آنها هستیم در معرض نوری قرار میگیرند که دارای انرژی منطبق بر انتقال الکترونیکی احتمالی در مولکول است، مقداری از انرژی نور با ارتقاء الکترون (پیوند π یا پیوند n) جذب میشود.
همیشه ارتقاء انرژی الکترون از “بالاترین اوربیتال مولکولی اشغال شده” (HOMO) تا “پایین ترین اوربیتال مولکولی اشغال نشده” (LUMO) خواهد بود، که حالتی برانگیخته را ایجاد می کند. اجازه دهید با نگاه کردن به یک مثال ساده انتقال الکترونیکی اتم گازی شروع کنیم. فرض کنید یک اتم منیزیم در حالت پایه فوتونی با طول موج 590 نانومتر را جذب کرده و به اولین حالت برانگیخته می رسد. الکترون از اوربیتال 3s به اوربیتال 3p انتقال یافته است.
فرض کنید اتم منیزیم فوتونی با طول موج 335 نانومتر را جذب کرده و به حالت برانگیخته دوم می رسد. اکنون یک الکترون از اوربیتال 3s به اوربیتال 4p انتقال یافته است. پیکربندی الکترونیکی یک اتم منیزیم حالت پایه [Ne]3s23p0 است. پیکربندی الکترونیکی اتم منیزیم حالت برانگیخته اول [Ne]3s13p1 و برای حالت برانگیخته دوم اتم منیزیم [Ne]3s13p04p1 است.
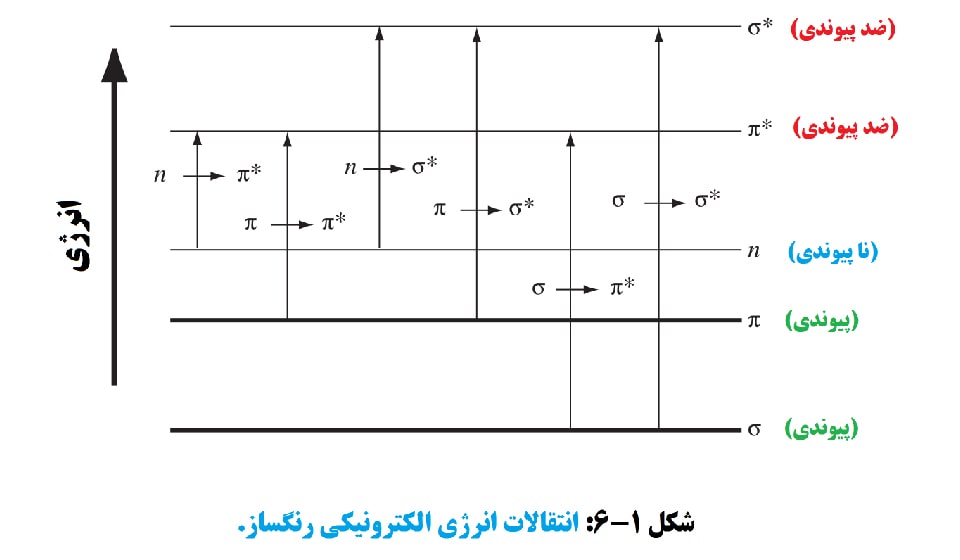
رفتار جذب نور برای مولکول ها کاملاً متفاوت از اتم منیزیم گازی ساده ای است که در مورد آن صحبت شد. سه نوع تغییر انرژی زمانی که مولکول ها انرژی نور را جذب می کنند وجود دارد: الکترونیکی، که تغییر در انرژی الکترون ها در مولکول است. ارتعاشی، که تغییر در فاصله اتم ها در مولکول است. و چرخشی که تغییر انرژی دوران مولکول به دور یک مرکز است.
انواع تغییرات انرژی الکترونیکی که رنگ ایجاد می کنند با دو انتقال مرتبط هستند که در شکل 1-6 نشان داده شده است. تغییرات انرژی شامل تغییرات ارتعاشی و چرخشی تغییرات انرژی کمتر در انرژی مادون قرمز است، در حالی که تغییرات الکترونیکی شامل انرژی های بالاتر در طیف های فرابنفش و مرئی است.
قانون بیر-لامبرت
مقدار جذب نور توسط یک ماده می تواند در طول موج های مختلف کم و زیاد شود. اغلب، ما از آنچه که حداکثر طول موج جذب نامیده می شود برای آناليز اسپکتروفتومتری استفاده می کنیم. همچنین ممکن است بدیهی باشد که با افزایش غلظت یک ماده در محلول، به دلیل وجود تعداد بیشتری از گونه ها، جذب مرتبط نیز افزایش می یابد. این ما را به یک رابطه مهم بین غلظت و جذب مورد استفاده در آزمایشگاه شيمي تجزيه به نام قانون بیر – لامبرت (یا به اختصار معمولاً قانون بير نامیده میشود) میآورد.
قانون بیر بیان می کند که جذب یک ماده متناسب با غلظت ماده، طول مسیری است که نور جذب کننده در نمونه طی می کند، و احتمال اینکه یک مولکول یا اتم فوتون را جذب كند، متناسب است. عبور نور از سل نمونه به سمت آشکارساز در شکل 1-7 نشان داده شده است. اگر نور فرودی P0 و نوری که از نمونه عبور کرده است P تعیین شود، می توانیم جذب (A) را به صورت تفاوت در لگاریتم های نور تابیده و نور عبوري بیان کنیم (شكل 1-7).

یک اسپکتروفتومتر برای اندازه گیری طول موج های مختلف جذب شده توسط آنالیت و میزان جذب استفاده می شود. طیف UV-Vis به دست آمده از یک اسپکتروفتومتر را می توان به دو صورت جذب (A) در مقابل طول موج (λ، nm) یا درصد عبور (%T) نشان داد. در آناليز کمی، جذب استفاده می شود و معمولاً از 0 تا 2 متغیر است. درصد عبور از 0 تا 100 متغیر است.

بدون دیدگاه